一、实验背景
在微生物制剂、益生菌制品及发酵体系研究中,菌体的活性与数量是决定产品功效和生物转化能力的关键指标。传统的平板计数法虽能评估活菌数量,但操作周期长、对亚健康细胞识别能力有限。随着现代分析技术的发展,流式细胞术(Flow Cytometry, FCM)已成为评估微生物活性最直接、灵敏且可定量的检测手段。该方法通过荧光染料标记细胞核酸,结合散射光信号,可在短时间内区分活菌、死菌及受损细胞,实现高通量、定量化分析。
(项目同类型分析:菌活性及数量检测实验报告(流式细胞术法)、微生物活性与数量流式检测实验分析、基于流式细胞术的菌体活性检测方法研究、流式细胞术在微生物活性定量分析中的应用、菌体活性检测实验及结果解析(流式细胞术)、益生菌活性检测实验报告(流式分析法)、流式检测在菌数量及活性分析中的应用实例、流式细胞术评估微生物群体活性与死亡比例研究、 微生物活菌比例检测实验报告(流式分析)流式细胞术在菌群活性研究中的应用与结果分析)
二、实验原理
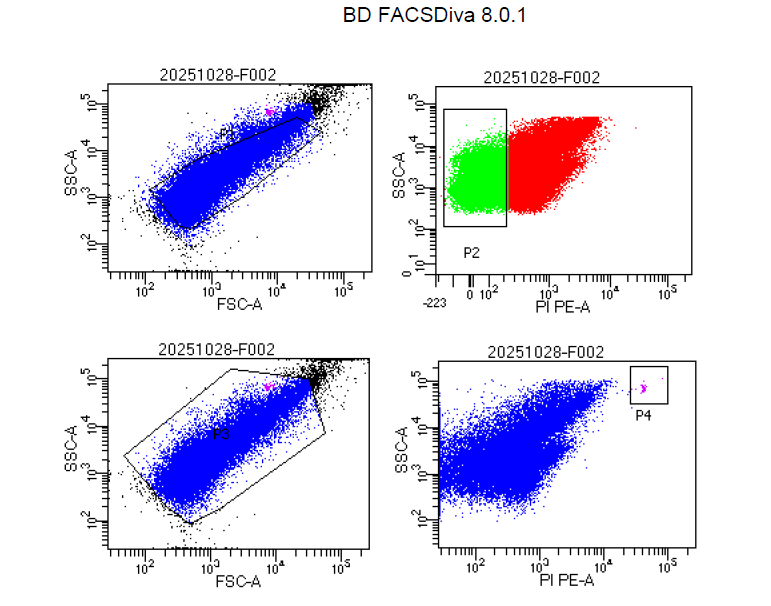
本实验采用 BD FACSCANTO II 流式细胞仪(美国 BD),配合 PI(碘化丙啶)染料进行细胞活性检测。PI 能选择性穿透受损或死亡细胞膜,与核酸结合后发出红色荧光,从而与未染色的活细胞区分。通过散射光与荧光信号的联合检测,可得到细胞群体的 FSC(前向散射)、SSC(侧向散射)及 PI通道荧光强度分布,从而判定细胞状态。
三、实验流程
1. 样品前处理:取约 0.5 g 样品(如益生菌粉末、发酵物或药丸等),加入 49.5 mL 0.85% NaCl-0.05% 吐温缓冲液中,在 18000 r/min 均质 80 秒,制得初始样液。
2. 上机检测:将样液 10000 g 离心 5 分钟,取上清液 10 μL 加入计数微球管,加入 5 μL PI 染料,震荡混匀后补加 500 μL 4°C 预冷 PBS 缓冲液,经轻混后上机检测。仪器设置为三光八色模式。
3. 检测与分析:仪器采集信号后,根据 PI 染色情况区分细胞群体:P1 区(全部事件)、P2 区(活细胞群,荧光信号低)、P4 区(死细胞群,PI 阳性)、Beads 区(计数微球)。样本活菌数量通过微球与样本信号比例计算,单位为个/mL。
四、实验结果与分析
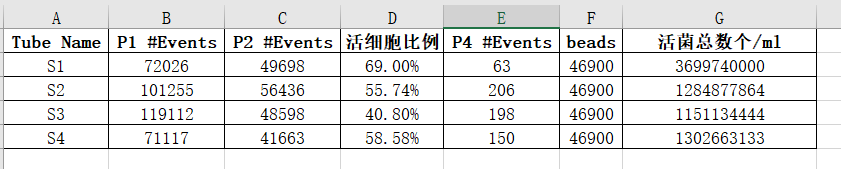
以 S1–S4 四个批次样品为例,活性检测结果如下:
S1:活细胞比例 69.00%,活菌总数 3.70×10⁹ 个/mL;S2:活细胞比例 55.74%,活菌总数 1.28×10⁹ 个/mL;S3:活细胞比例 40.80%,活菌总数 1.15×10⁹ 个/mL;S4:活细胞比例 58.58%,活菌总数 1.30×10⁹ 个/mL。
结果显示,各样品活细胞比例在 40%–70% 之间,说明不同批次样品活性存在差异。流式检测能准确识别群体结构差异,体现了方法在产品质量控制中的灵敏性与区分度。
检测结果:
五、应用场景
1. 益生菌产品质量控制:评估产品中活菌与死菌比例,判断储存与冻干工艺对活性的影响。
2. 发酵体系优化:用于监测发酵过程微生物状态变化,指导补料与终点判定。
3. 药用与饲用菌制剂研究:验证制剂中活菌数量及细胞膜完整性。
4. 微生态制剂稳定性研究:考察运输、保存或配方中活菌存活率。
5. 科研实验应用:用于菌株应激、抗氧化或抑菌研究的定量指标。