期刊:Journal of Medicinal Chemistry
DOI:10.1021/acs.jmedchem.5c02541
前言
在癌症治疗领域,免疫疗法通过激活患者自身免疫系统攻击肿瘤,已成为一种革命性策略。
Casitas B淋巴瘤原癌基因-b(CBLB)作为关键调控分子,已成为备受关注的新靶点。CBLB属于RING E3泛素连接酶Cbl家族,通过靶向T细胞受体(TCR)信号通路负调控免疫细胞活性。抑制CBLB不仅可增强T细胞和NK细胞的抗肿瘤功能,还能与PD-1/PD-L1抗体产生协同增效作用。
目前已有多个研究团队和制药公司正在开发CBLB抑制剂,其中进展最快的是NX-1607,该药物已进入I期临床试验阶段。然而,现有药物在结构多样性、药效、代谢稳定性及成药性方面仍存在优化空间。因此,开发结构新颖、活性更强、口服可用且更适合联合治疗的CBLB抑制剂,成为当前研究的重要方向。
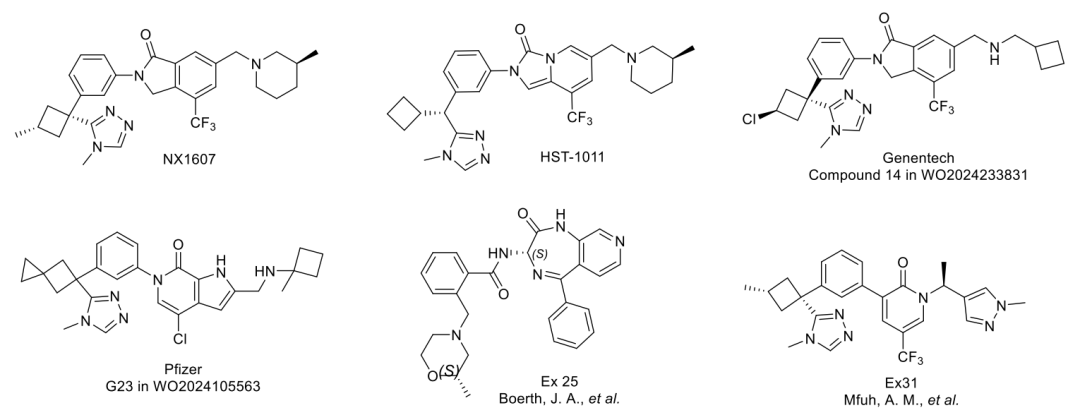
图1. 代表性 CBLB 抑制剂结构
近日,Insilico Medicine的Alex Zhavoronkov等科研人员基于NX-1607 的结构,通过结构引导的药物设计 和AI辅助优化,开发出了一种新型口服CBLB抑制剂。研究突破了NX-1607类母核的结构局限,获得了新颖骨架衍生物,在保持高效力的同时将口服生物利用度与肿瘤暴露量推至新水平,标志着CBLB抑制剂进入开发进入 “活性-成药性-靶向性” 协同优化的新一代。
研究以“Discovery and Biological Evaluation of Novel, Potent, and Orally Available CBLB Inhibitors”为题发表在《Journal of Medicinal Chemistry》上。

研究内容
先导化合物的发现
研究以NX-1607为起点,利用 Chem42 AI 平台进行配体导向药物设计,通过环扩张策略获得化合物1,活性略低但代谢稳定性更好。

图2. A) 基于配体的药物设计方法发现 CBLB 抑制剂的工作流程;(B)A区生成的代表性新型骨架
构效关系(SAR)优化
通过解析化合物1 与 CBLB 的共晶结构(分辨率 1.95 Å,PDB: 9WGU),明确了关键相互作用模式:三唑环与 Tyr363 形成 π-π 堆叠、与 Tyr260 形成氢键,质子化哌啶与 Glu268 形成盐桥。
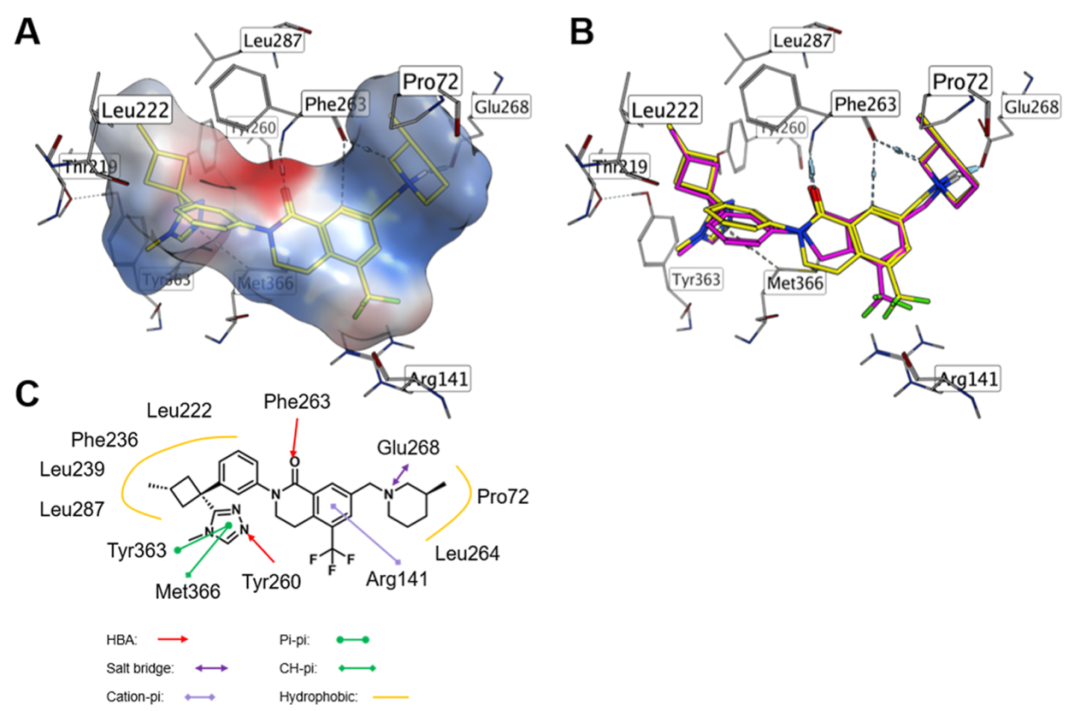
图3. 化合物1与CBLB的共晶结构
基于上述结构信息,团队系统优化了Region A(核心骨架)和Region B(三唑部分),通过引入氮原子、调整环大小及优化疏水相互作用等方式,最终获得了化合物10。该化合物活性与NX-1607相当,且膜通透性与代谢稳定性进一步改善。
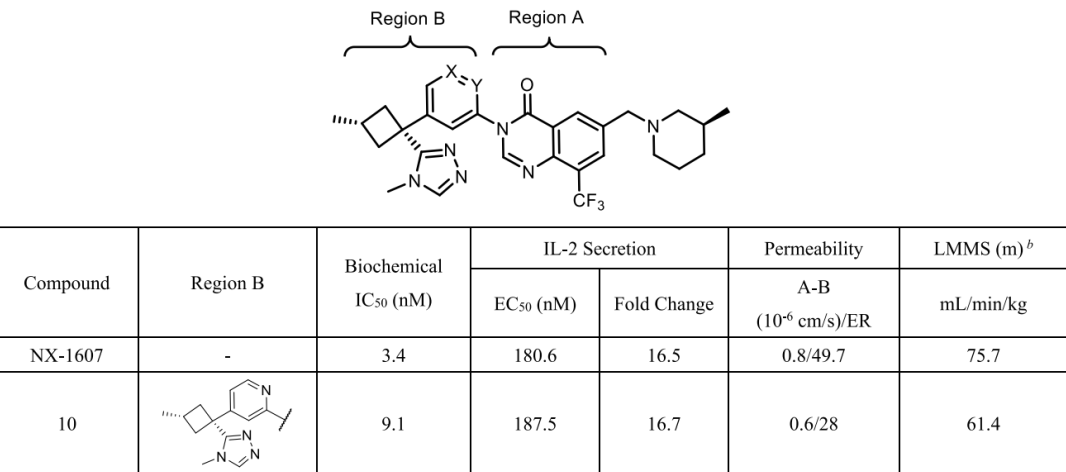
表1. 化合物10的化学结构及活性和药代性质
化合物10的体外与体内药效评价
化合物10在多种肝微粒体和肝细胞中代谢稳定,渗透性良好,血浆蛋白结合率低。
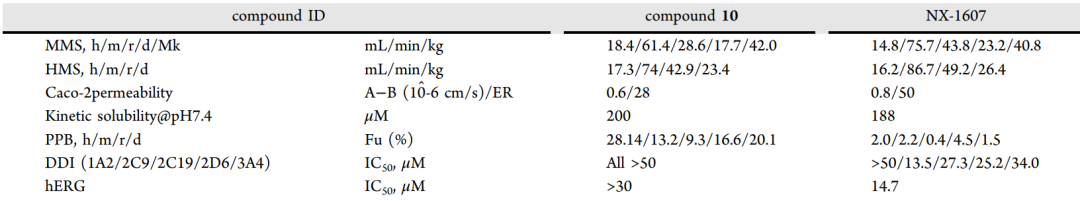
表4. 化合物10与 NX-1607 的体外 ADMET 特性对比
在CT26小鼠模型中,单药效果有限,但与抗PD-1抗体联用表现出强效协同作用。
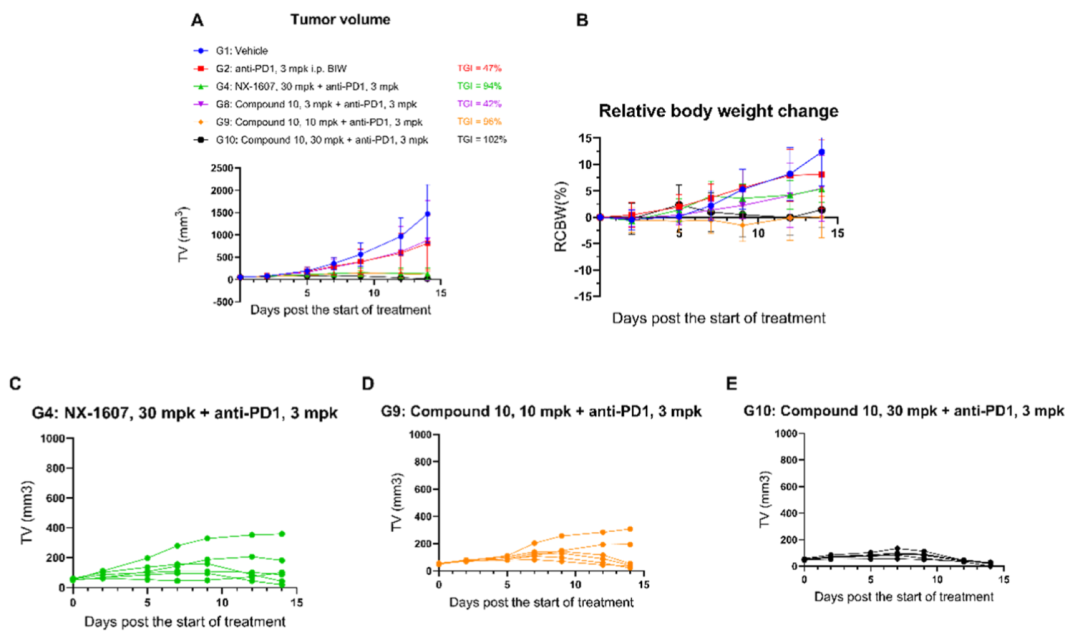
图4. 化合物10 在CT26 小鼠模型中的体内疗效
完全缓解小鼠停药30天后再次接种CT26 肿瘤细胞,未观察到肿瘤形成,而对照组小鼠肿瘤体积均超过1500mm³ 并全部死亡,表明化合物10可诱导长效抗肿瘤免疫记忆。

图5. 化合物10在CT26小鼠模型再挑战实验中的体内药效
PK/PD分析
化合物10口服生物利用度较 NX-1607 显著提高,清除率更低、全身暴露量(AUC)更高,且肿瘤 / 血浆浓度比达 1.3–1.7,显示出更优的肿瘤靶向性。药效学显示其可剂量依赖地调控 CBLB 响应基因签名,并增加瘤内 CD8⁺T 细胞与 NK 细胞浸润。暴露-效应关系表明,当化合物10的游离血浆浓度达 IL-2 EC₅₀(187 nM)以上时,即产生明显抗肿瘤作用,这一紧密 PK/PD 关联为其临床开发提供了量化依据。
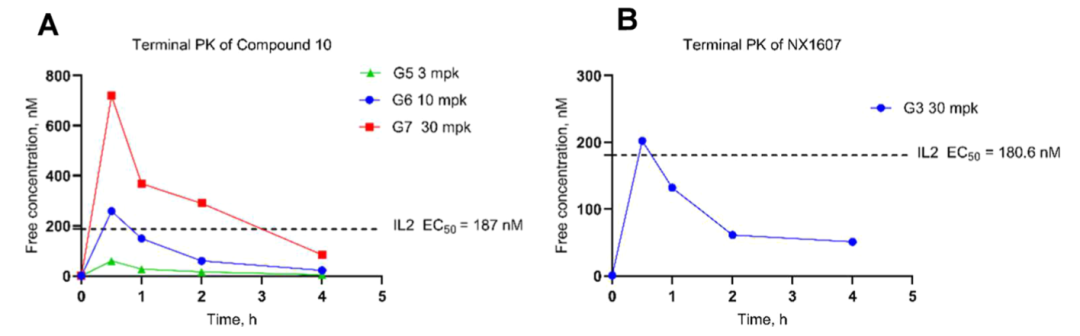
图6. 末端PK分析
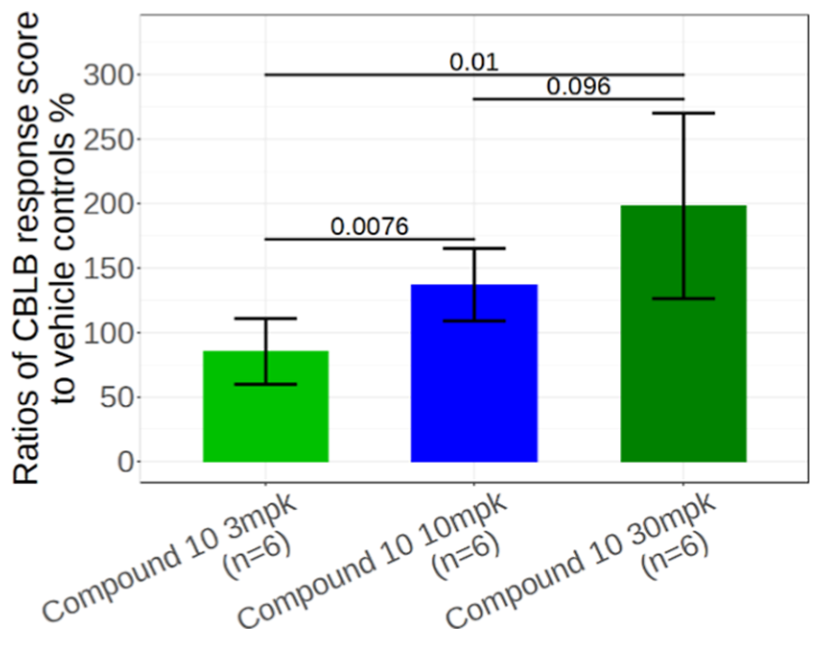
图7. 化合物 10 剂量依赖性调节 CBLB 反应评分
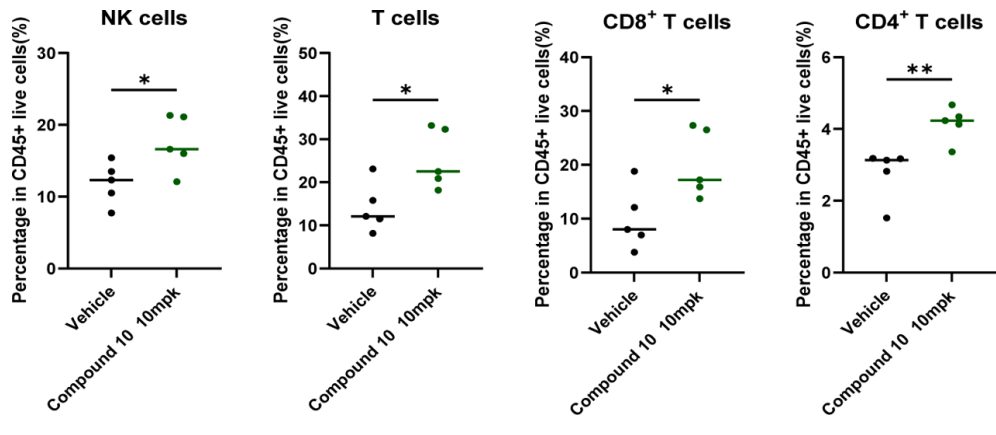
图8.TIL分析
结论与展望
本研究通过AI辅助药物设计与结构导向优化,成功开发出新型口服CBLB 抑制剂化合物10。该化合物具有强效、高选择性、良好成药性及显著的体内抗肿瘤活性,与抗 PD-1 疗法联合使用时协同增效,并能诱导长效免疫记忆,为肿瘤免疫治疗提供了新的候选药物。同时,研究阐明的构效关系和作用机制,为 CBLB 抑制剂的进一步优化和临床转化奠定了重要基础,有望为难治性肿瘤患者提供新的治疗选择。
在本研究中,结构生物学手段发挥了至关重要的指导作用。通过解析先导化合物1与CBLB的共晶结构,研究团队直观地揭示了其结合模式,指引了后续的理性药物设计,使团队能够有针对性地优化分子构象,成功恢复了与关键氨基酸残基(如Phe263)的相互作用,从而系统性地提升了最终候选化合物10的效力,充分体现了结构引导策略在先导化合物优化中的强大作用。