HOMO – LUMO的大小反映了分子得失电子的难易程度,能隙越小,分子越容易发生电荷转移。HOMO-LUMO能隙变大、变小是哪些原因导致的呢?本文华算科技从、、、、、等方面进行详细讨论。
一、什么是HOMO与LUMO?
HOMO与LUMO共同构成分子的前线轨道,其能量差即为HOMO-LUMO能隙(ΔEH-LHOMO-LUMO能隙的本质是电子从HOMO跃迁至LUMO所需的最低能量电子从HOMO跃迁到LUMO的能量壁垒,能隙越小,越容易,分子的反应活性和导电性通常越高;反之则分子更稳定,反应活性更低。
二、能隙大小的影响因素
1. 共轭体系
共轭链的长度、连续性和分布直接影响电子离域范围,对能隙的影响最为显著。若共轭链中引入非共轭基团,如饱和碳链 – CH₂-,或分子扭曲导致 π 轨道重叠受阻,电子离域范围缩小,HOMO 能量降低、LUMO 能量升高,能隙变大。
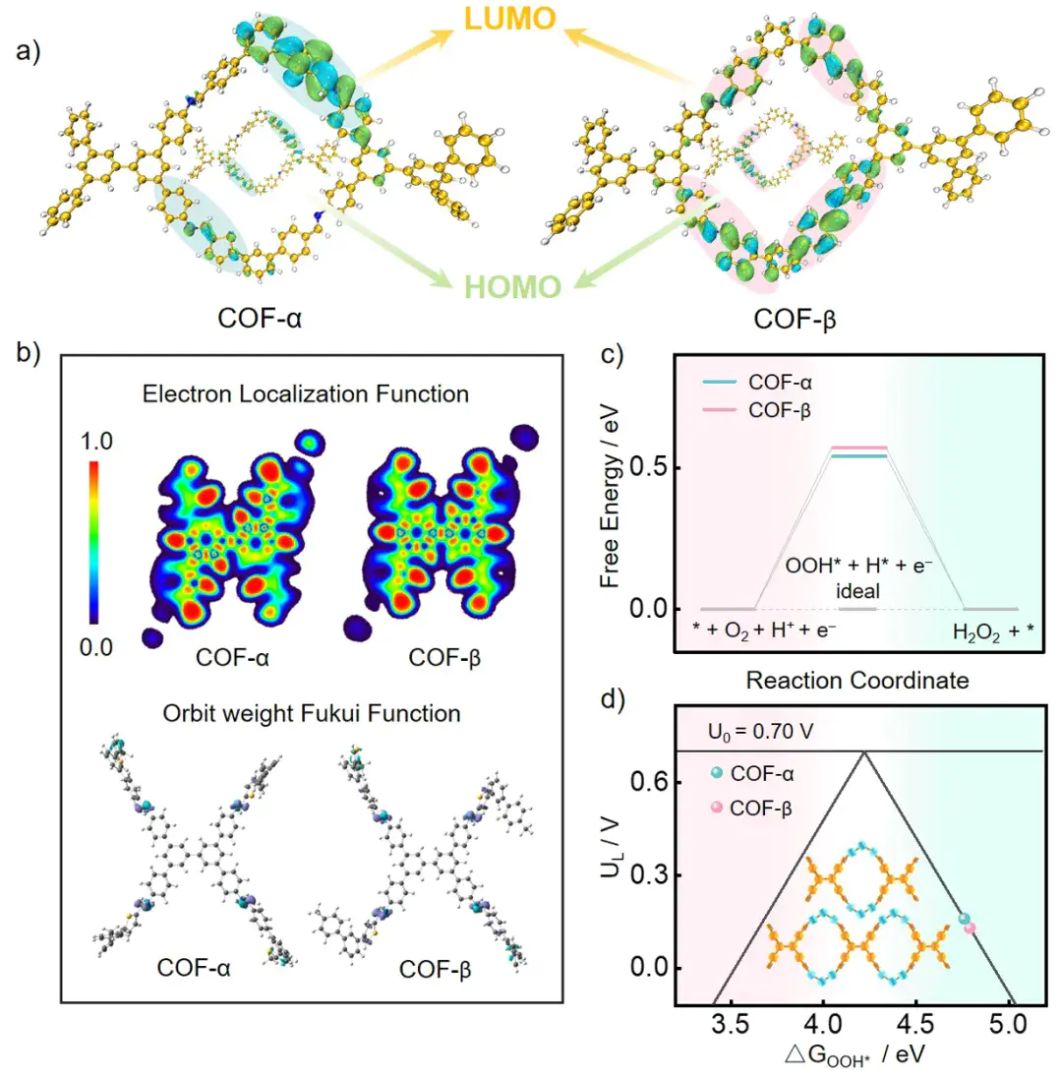
不对称异构COFs的LUMO、HOMO轨道。10.1002/anie.202520336
2. 取代基效应
取代基通过诱导效应或共振效应改变分子的电子云分布,进而定向调节 HOMO 或 LUMO 的能量,最终实现能隙的精准调控。
会使 HOMO 轨道上的电子密度显著增加,进而导致 HOMO 能量升高,而对 LUMO 轨道能量的影响相对较小,这种选择性调节最终会让分子的能隙变小。
因此,推拉电子体系(D-π-A)是更高效的方式,。分子几何构型:分子平面性和扭转角影响π轨道重叠效率。平面性共轭体系中的也会影响能隙,键长交替越小(即 C-C 键长越接近平均键长),电子离域越均匀,能隙越小。同样会改变能隙大小,小环共轭分子因环结构限制导致键角异常,π 轨道重叠效率受限,能隙较大;而大环共轭分子环张力小,共轭链连续且完整,电子离域范围广,能隙显著降低。
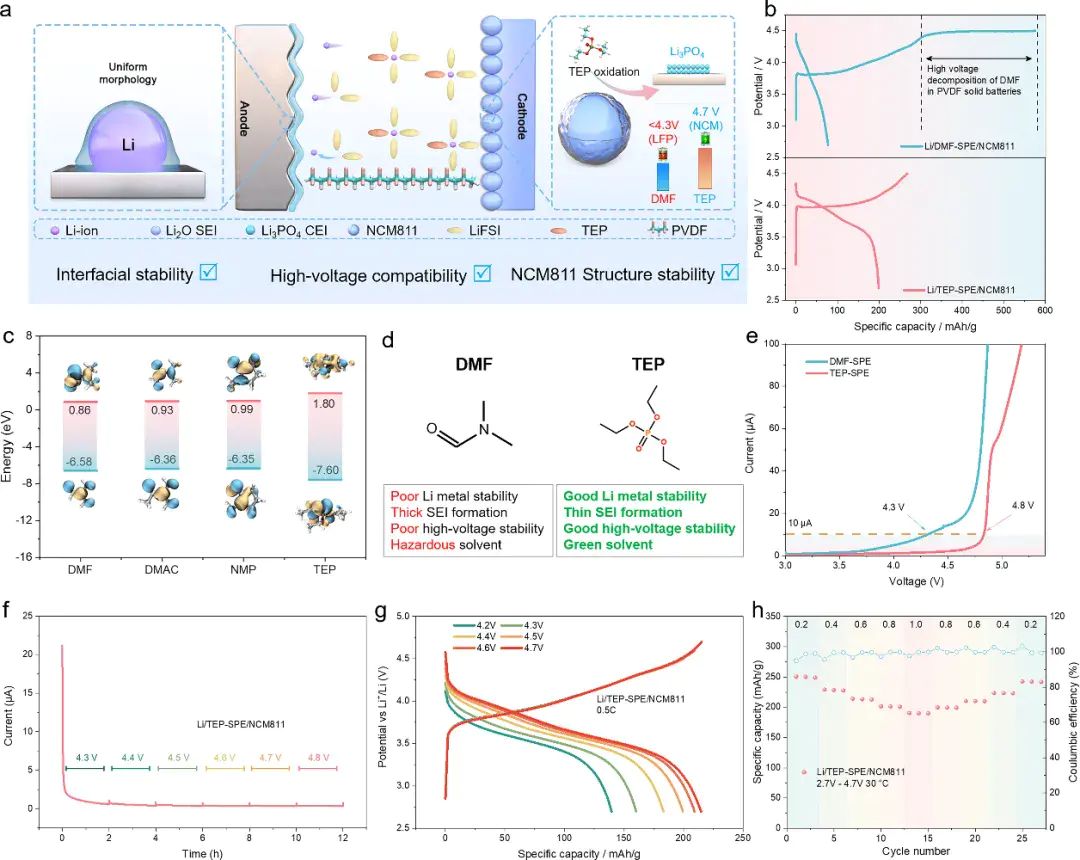
DMF、DMAC、NMP和TEP的LUMO与HOMO能值DOI:10.1021/jacs.5c08493
4. 杂原子与轨道组成
在有机分子中引入 N、O、S、B 等杂原子,或改变轨道杂化类型,。
由于孤对电子的能量本身高于碳原子的 π 电子,其参与共轭后会显著提升 HOMO 轨道的能量,对 LUMO 轨道能量影响较小,最终导致分子能隙变小。
轨道杂化类型的差异也会直接影响能隙大小溶剂的极性通过,选择性稳定分子的HOMO或LUMO轨道,从而灵活改变能隙大小,这是溶液相体系中能隙调控的重要方式。
温度变化会通过影响分子构象间接调节能隙但对于柔性分子而言,高温可能促使分子链伸直,形成更接近平面的构象,反而增强 π 轨道重叠,使能隙变小,因此温度对能隙的影响需结合分子结构的刚性或柔性具体分析。
,压力增大时,分子间距离减小,π-π 堆积作用增强,分子间轨道相互作用加剧,形成连续的晶体轨道,导致能级发生分裂,HOMO 和 LUMO 的能量差缩小,能隙变小。
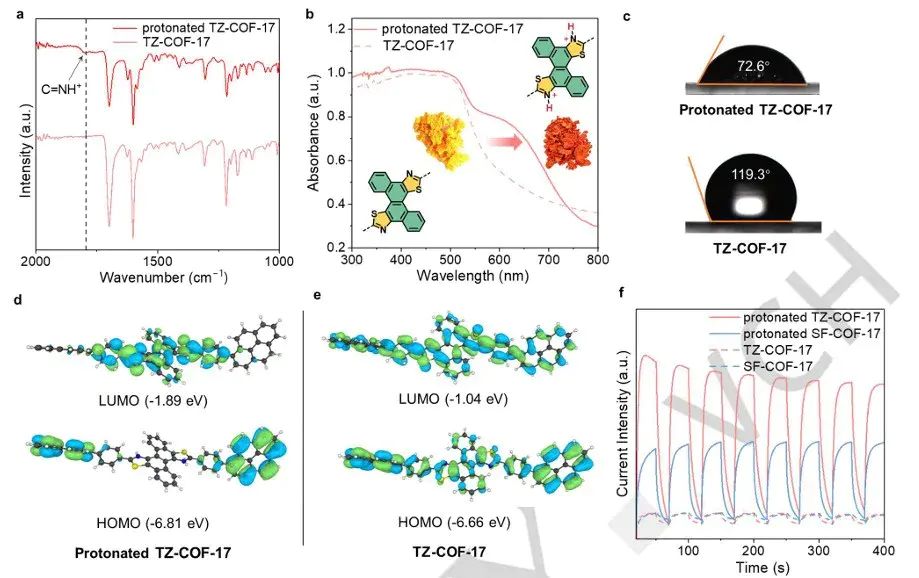
0.1002/anie.202511245
三、总结
HOMO-LUMO能隙的变化本质是HOMO与LUMO轨道能量的相对移动。
UV-VISDFT计算Mulliken布居分析