

Bergman 环化反应(伯格曼环化反应),又称Bergman 反应、Bergman 芳构化反应,是指共轭的烯二炔通过分子内环化生成 1,4-苯双自由基(对苯炔)或其类似物的一类环化反应。这个反应是由美国化学家 Robert George Bergman 在 1972 年发现的。
反应机理:启动反应的关键反应条件是加热或者光照。第一步烯二炔环化为苯双自由基的反应是一个典型的可逆电环化反应,一般产生的苯双自由基接下来与反应体系中氢供体(如1,4-环己二烯)作用,产生苯的衍生物,1,4-环己二烯则转化为芳香性的苯。但是如果反应体系中不存在氢供体,那么就很容易发生自由基之间的偶联反应。
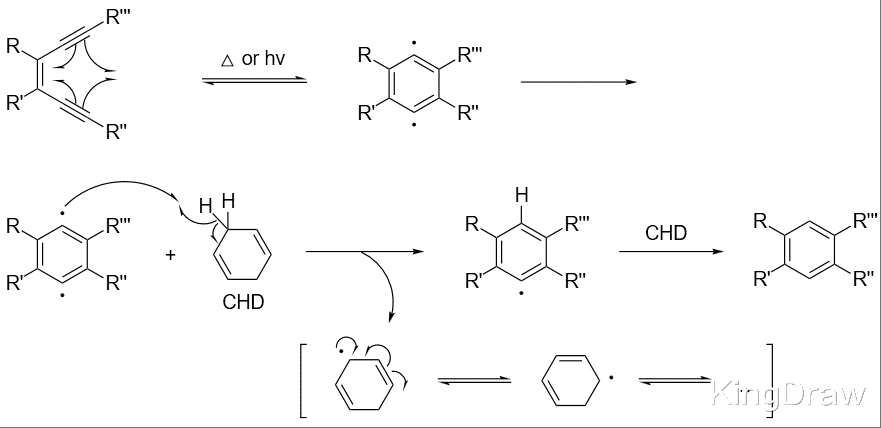
该反应在 20 世纪 70 年代首次报道时,很少受到关注。在 20 世纪 90 年代,当某些含有烯二炔基团的海洋天然产物通过双链 DNA 的切割显示出显著的抗肿瘤活性时,它成为了研究的热点。
其中一个例子就是卡奇霉素(calicheamicin),Bergman 环化反应机制是造成这些化合物具有细胞毒性的关键。当卡奇霉素的分子和目标细胞接触后会造成本身分子构型的改变,进而引发 Bergman 环化反应产生类苯双自由基之中间体,而此中间体会去攻击任何附近的 DNA 分子,最后导致细胞凋亡。

而后也陆续发现许多其它包含烯双炔的天然物,由于它们特殊的化学结构及其突出的生物学特性,许多全合成化学家都对这类分子产生极大的兴趣。由于它们都具有很强的抗癌活性,因此在室温下进行 Bergman 环化反应的研究吸引了很多研究者的注意。现在对于此课题最多的研究是 Bergman 环化反应的动力学参数。
理论上所有包含共轭烯二炔结构的底物都有可能发生 Bergman 环化反应,但实际上各种底物的反应性随着两个炔基之间距离的不同而有很大的差别。Nicolaou 提出两个炔外端碳原子的距离(cd值)越小时环化越容易进行,而且距离在 3.20~3.31 Å 之间时反应才会在室温下进行。例如,1,2-二(二苯基膦基乙炔基)苯经过与 Pd2+ 配位后,发生环化反应的温度可以大大降低。类似也可推测出环状的共轭烯二炔比非环烯二炔更容易发生环化。正如下面的例子中,只是结构上的微小改变就导致了环化反应:

与 Bergman 环化相比,烯炔的 Myers-Saito 环化表现出低得多的活化温度,同时遵循类似的途径:
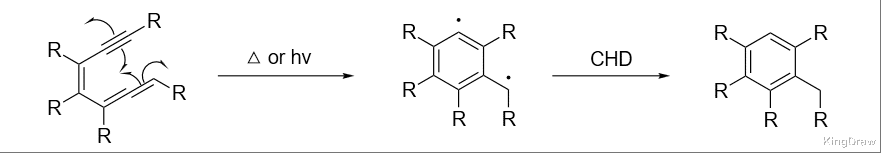
环状烯二炔也有反应活性。早期在日本主要用来治疗癌症的药物为新抑癌素(neocarzinostatin),此药物分子包括一个极不稳定的发色团,具环氧双炔官能基。它首先发生 Myers-Saito 环化,然后再导致 DNA 裂解:

为了合成的目的,有机金属试剂能够产生 Bergman 环化反应的前体,在前体中能够形成一种半配位的不饱和系统;这类环化反应发生在相对较低的温度,例如Finn报道的反应(J. Am. Chem. Soc.1995, 117, 8045),在此反应中可视为发生了一个 Myers-Saito 环化,产生了一个金属中心的自由基:

对更多天然化合物的螯合成环和最新的 Bergman 环化反应的催化剂的研究,请参阅文章 (Chem. Rev. 2003, 103, 4077. DOI).
相关文献: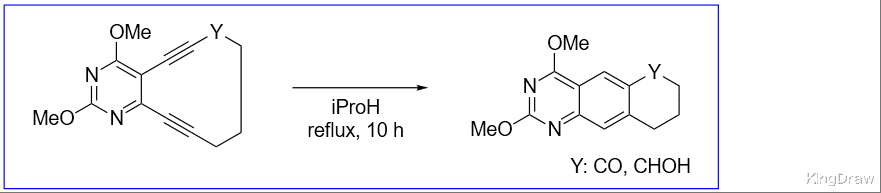
Photochemical and Thermal Bergman Cyclization of a Pyrimidine Enediynol and Enediynone
N. Choy, B. Blanco, J. Wen, A. Krishan, K. C. Russel, Org. Lett., 2000, 2, 3761-3764.
内容来源:https://www.organic-chemistry.org
