一、实验背景与原理
RNA甲基化修饰是表观转录调控的重要形式,其中N6-甲基腺苷(m6A)是最常见且研究最深入的RNA修饰类型之一。m6A修饰广泛存在于真核生物mRNA和长链非编码RNA(lncRNA)中,与RNA的稳定性、剪接、翻译效率及降解过程均具有重要影响。
本实验采用 Bio.ruqi RNA甲基化免疫共沉淀试剂盒(MeRIP Kit,货号RQM008-01/02/03),利用m6A特异性抗体结合并富集具有m6A修饰的RNA片段。该方法结合Trizol提取、RNA片段化、免疫共沉淀、Protein A/G磁珠结合与qPCR定量检测,可系统评估目标RNA的甲基化修饰水平。
实验基于免疫共沉淀原理:将随机打断的RNA与m6A抗体反应形成免疫复合物,再通过Protein A/G磁珠捕获沉淀带有甲基化修饰的RNA片段,随后回收RNA并反转录为cDNA,用于qPCR检测或后续测序分析。
二、实验材料
主要试剂:PMSF(Genstar,B111-01)、磷酸酶抑制剂(Selleck,B15001)、蛋白酶抑制剂(Selleck,B14001)、反转录试剂盒(TAKARA,RR037A)、Anti-N6-methyladenosine (m6A) 抗体(Abcam,ab208577)、RNA甲基化免疫共沉淀试剂盒(Bio.ruqi,RQM008-01/02/03)、qPCR mix(Yeasen,11202ES03)。
主要仪器:高速冷冻离心机(湘仪 TGL-16)、PCR仪(BIO-RAD PTC-100)、磁力架(Thermo DynaMag™-2)、荧光定量PCR仪(Thermo Fisher ViiA7)、垂直混匀器(Kylin-Bell BE-1100)。
三、实验步骤
(一)RNA提取:收集1×10⁷个293T细胞,用预冷PBS漂洗两次,1000 rpm离心5 min去除上清。加入1 mL Trizol裂解细胞,吹打均匀后室温静置5 min。每1 mL Trizol加入200μL氯仿,剧烈震荡15 s后室温放置3 min。以12000 g、4℃离心15 min后,取上层水相约500μL转入新管,加入等体积异丙醇沉淀RNA。以75%乙醇洗涤两次,晾干后溶于RNase-free水,-80℃保存。
(二)RNA片段化:取10μL RNA(总量≥10μg)加入等体积Frag Buffer,94℃孵育6–7 min,冰浴终止反应。使用酚氯仿抽提RNA并配制1%琼脂糖凝胶检测片段长度(约100–300 nt)。取2μL RNA作为Input样本,其余分为m6A组与IgG组。
(三)免疫共沉淀:m6A组与IgG对照组分别加入试剂盒提供的RNA Binding Buffer(10×)、RNase Inhibitor及对应抗体(m6A抗体4 μL或IgG抗体2 μL),补足DEPC水至100 μL体系,4℃孵育4小时(或过夜)。
(四)Protein A/G磁珠结合:加入20 μL Protein A/G磁珠,4℃混匀孵育2小时后置磁架分离。加入200 μL Wash Buffer轻轻吹打混匀,在4℃洗涤5分钟;重复洗涤3次。
(五)RNA纯化与反转录:将免疫沉淀物加入1 mL Trizol裂解液,裂解15分钟后提取RNA。取回收RNA按比例配置反转录体系:5× PrimeScript Buffer 2μL、PrimeScript RT Enzyme Mix I 0.5μL、Random 6 mers 0.5μL、RNA样品 7μL,37℃反应15分钟,85℃终止5秒。所得cDNA用于qPCR分析。
(六)qPCR检测:每10μL反应体系含Master Mix 5μL、Forward Primer 0.2μL、Reverse Primer 0.2μL、cDNA 2μL、RNase-free水补足至10μL。反应程序为:95℃ 5 min预变性,40循环(95℃ 10 s,60℃ 30 s),随后进行熔解曲线分析。

图1:试剂盒图片
四、实验结果
实验以293T细胞为模型检测HIF1A基因RNA的m6A修饰情况。qPCR结果显示,m6A抗体组样本Ct值明显低于IgG组,说明HIF1A mRNA存在显著m6A修饰。熔解曲线单峰表明扩增特异性良好,RNA片段化电泳结果显示片段主要分布在100–300 nt之间,符合MeRIP实验要求。
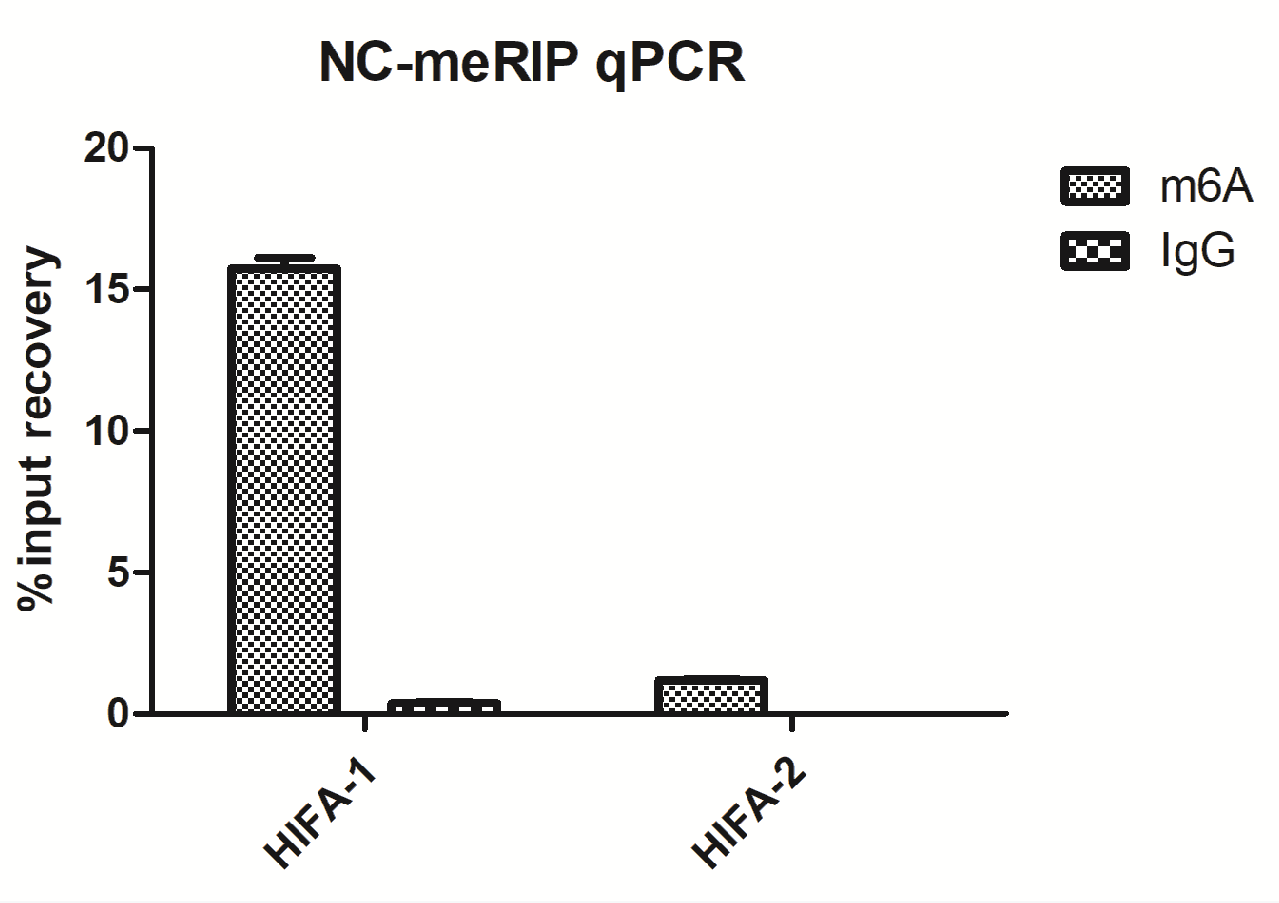
图2:MeRIP-qPCR柱状图
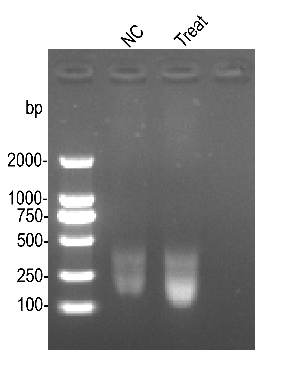
3:RNA片段化电泳图
五、实验总结与特点
本实验基于 Bio.ruqi RNA甲基化免疫共沉淀试剂盒(MeRIP Kit,RQM008-01/02/03),完成了从RNA片段化到m6A富集与检测的全流程操作。该试剂盒包含完整实验体系,包括m6A抗体、IgG对照抗体、Frag Buffer、Protein A/G磁珠、RNA Binding Buffer与Wash Buffer,可满足RNA甲基化免疫共沉淀实验各步骤需求。
实验结果稳定、重复性良好,检测灵敏度高,可用于低丰度RNA修饰分析。该方法适用于RNA甲基化研究、基因表达调控与转录后修饰机制研究、肿瘤与代谢疾病机制研究及RNA修饰位点筛查。
六、结论
通过RNA甲基化免疫共沉淀(MeRIP)方法,可有效检测目标RNA的m6A修饰水平。本实验验证了HIF1A基因RNA中存在明显m6A修饰,结果可靠且特异性强。使用Bio.ruqi MeRIP试剂盒可实现从RNA提取到甲基化检测的标准化流程,适用于科研人员开展RNA表观修饰研究。
本实验所得的RNA样本不仅可用于qPCR验证,还可用于高通量测序(MeRIP-seq)分析,以研究全转录组范围内RNA甲基化修饰的分布与功能。
如需获取详细操作说明书及完整试剂组成,可私信索取《RNA甲基化免疫共沉淀试剂盒(MeRIP Kit)说明书》。