期刊:Science
DOI:10.1126/science.ady2708
前言
微管是真核细胞骨架的关键组成部分,对细胞分裂、细胞内物质运输及细胞形态维持至关重要。
微管蛋白由 αβ-微管蛋白异二聚体构成,其组装与解聚过程依赖于一类称为微管蛋白结合辅助因子(TBCs)的伴侣蛋白,包括 TBCA、TBCB、TBCC、TBCD、TBCE;此外,小GTP酶Arl2也参与调控该过程。
尽管这一过程对于维持细胞骨架稳态至关重要,其原子水平的结构机制长期以来尚不明确。
2025年10月30日,首尔国立大学Soung-Hun Roh团队通过冷冻电镜解析了六种微管蛋白结合辅助因子(TBCs)的高分辨率结构(2.1-2.5 Å),首次从结构层面揭示了TBCs与Arl2作为分子开关与GTP酶调控中心,共同介导αβ-微管蛋白异源二聚体“解聚-组装”双向调控的分子机制。

αβ-微管蛋白异二聚体组装-拆卸循环示意图
该研究以“Structural dissection of αβ-tubulin heterodimer assembly and disassembly by human tubulin-specific chaperones”为题发表在《Science》上。

研究内容
复合物重构与结构解析
研究团队从哺乳动物细胞中纯化了人源TBCDE–Arl2复合物及TBCC,并在大肠杆菌中表达TBCA和TBCB。在特定GTP条件下,将上述组分与αβ-微管蛋白重组,成功获得六个结构状态的高分辨率冷冻电镜结构(分辨率为2.1–2.5 Å)。

图1. TBC-微管蛋白复合物的6种结构状态重构
六种结构状态(State I–VI)
▶ 无GTP的解聚状态
在无GTP条件下,复合物处于State I(TBCD–Arl2–β-微管蛋白)和State II(TBCDE–Arl2–β-微管蛋白)。此时α-微管蛋白完全解离,仅β-微管蛋白被解析,其通过静电互补作用被稳定。
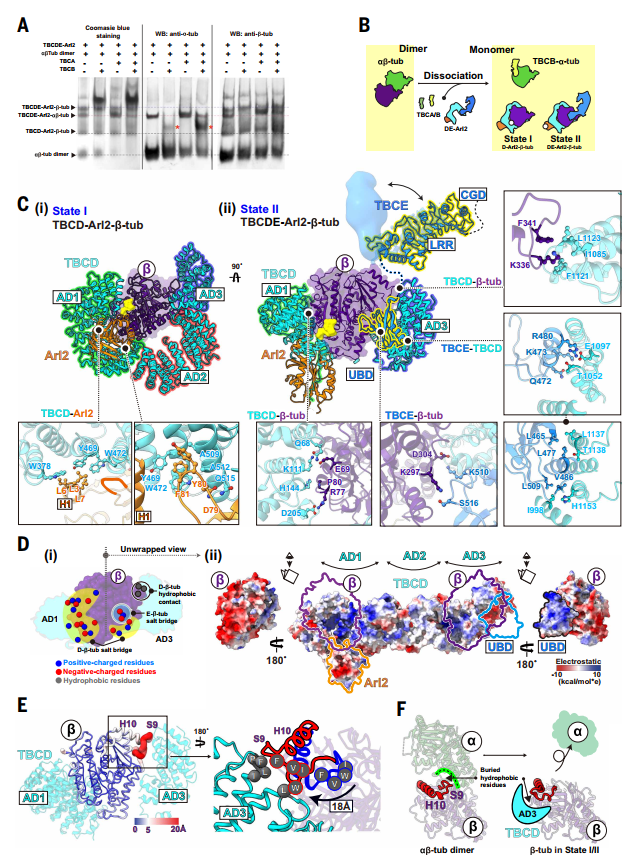
图2. TBC复合物分解微管蛋白异二聚体并稳定β-微管蛋白单体
▶ GTP触发组装启动
加入GTP 后,Arl2 在State III(TBCDE-Arl2GTP-β-微管蛋白)中发生显著构象变化,使TBCD 的AD2 结构域位移,解除对α-微管蛋白结合的空间位阻,进而形成State IV(TBCDE-Arl2GTP-αβ-微管蛋白)。此时 α-微管蛋白可被解析,表明异二聚体进入部分组装状态。

图3. GTP诱导的TBCs构象变化启动αβ-微管蛋白异源二聚体组装
▶ 异源二聚体组装完成
研究进一步利用GTP-AlFx模拟GTP水解后状态,发现TBCC通过两个结构域分步发挥作用:在State V中,其调控结构域(RPD)结合Arl2的GTP结合位点,辅助其GTP酶活性;在State VI中,TBCC的卷曲螺旋结构域(CCD)作为“分子夹子”桥连α/β-微管蛋白,同时促使TBCE解离,使异源二聚体形成天然界面,完成组装。

图4. TBCC 介导异二聚体组装完成
▶ TBCD:β-微管蛋白的GAP
结构分析还揭示了TBCD作为β-微管蛋白的GTP酶激活蛋白(GAP)的关键功能。β-微管蛋白的GTP水解与Arl2的GTP酶活性相耦合,形成“双重质控检查点”,确保仅释放完全组装成熟的异二聚体。
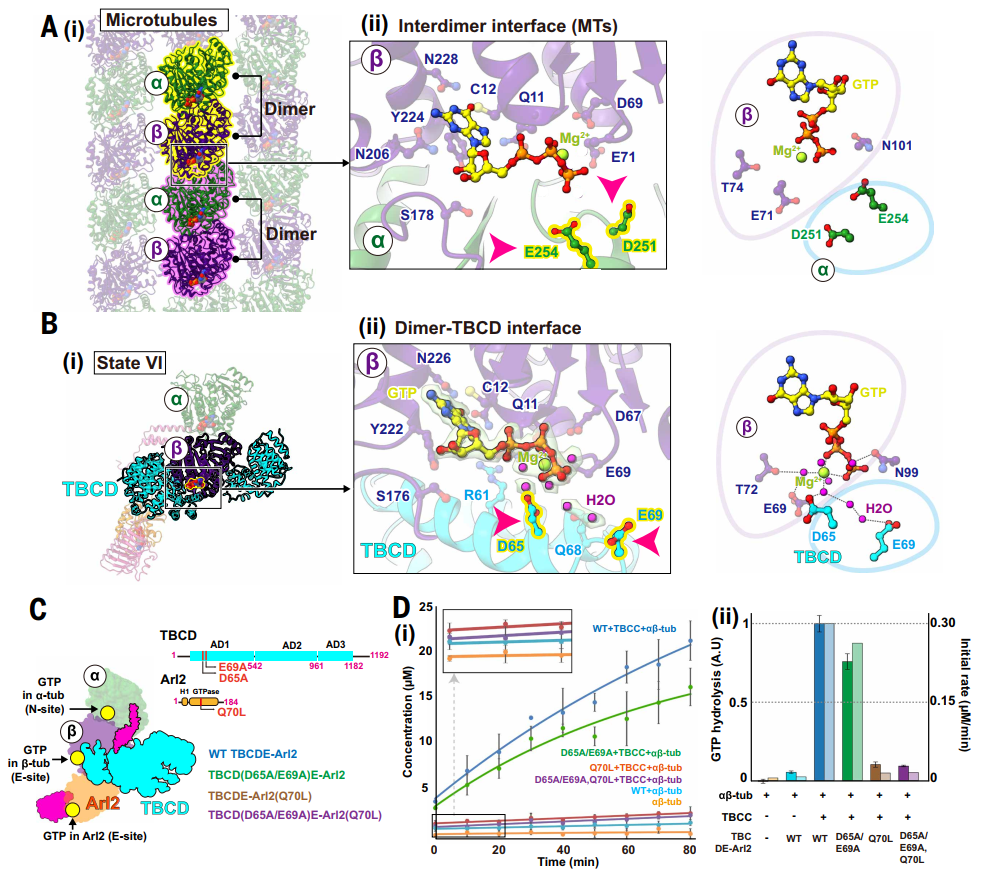
图5. TBCD作为β-微管蛋白的GAP发挥作用
总结
本研究通过高分辨率冷冻电镜结构解析,首次系统揭示了TBCs与Arl2在αβ-微管蛋白异二聚体组装与解聚过程中的分子机制:Arl2通过其GTP结合状态作为分子开关,驱动TBCs发生构象变化,从而实现“无GTP时解聚、有GTP时组装”的动态调控;Arl2与β-微管蛋白的协同GTP水解活性构成了严格的质量控制机制,确保微管蛋白稳态的精确调节。
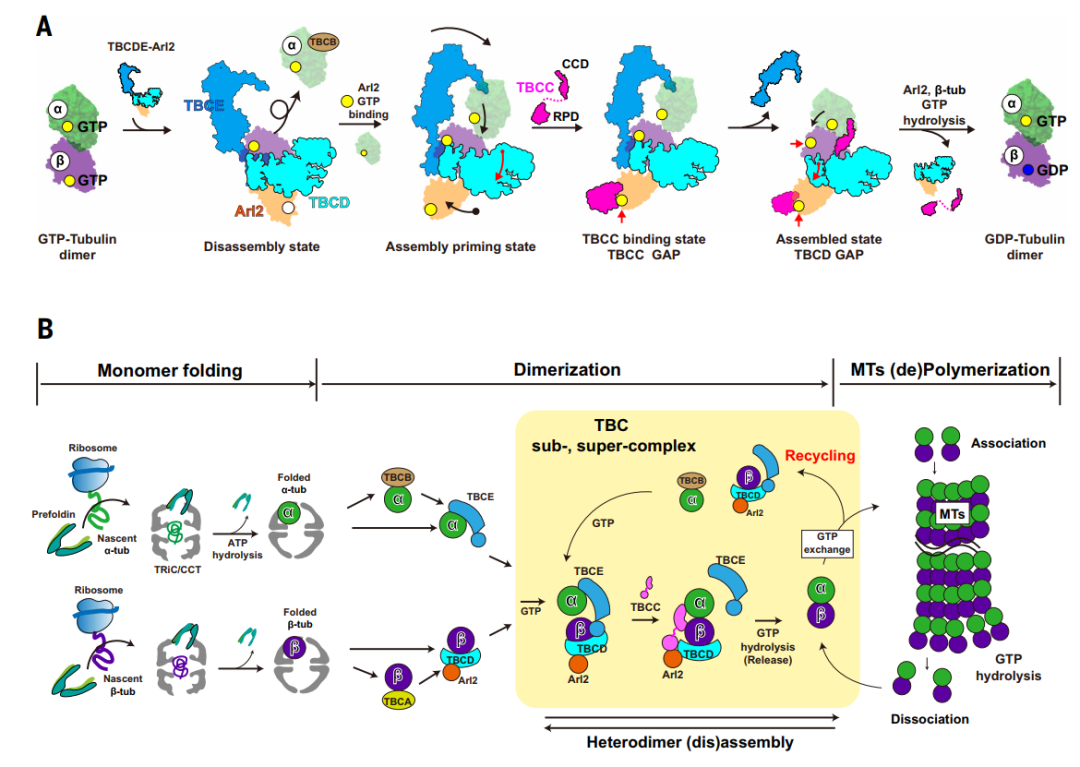
图6. TBCs在微管蛋白折叠、组装、回收和质量控制中的作用
这项工作修正了此前对 TBCs 功能的单一认知,将其角色从传统的组装辅助因子提升为微管蛋白稳态的核心调控者,为理解微管蛋白质量控制、细胞骨架稳态维持 及相关疾病(如神经退行性疾病、癌症)提供了结构基础。